慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)简称慢阻肺,是一种以持续气流受限为特征的可防可治的常见病、多发病。
COPD 常用治疗药物包括:支气管扩张剂、糖皮质激素、抗生素、止咳祛痰药等治疗用药。
支气管扩张剂是慢阻肺的基础一线治疗药物,通过松弛气道平滑肌扩张支气管,改善气流受限,从而减轻慢阻肺的症状,包括缓解气促、增加运动耐力、改善肺功能和降低急性加重风险 [1]。支气管扩张剂主要有 β2 受体激动剂、抗胆碱能药物及茶碱类药物,可根据药物作用及患者的治疗反应选用。
慢阻肺病程可分为急性加重期(AECOPD)和稳定期。本文主要探讨氨茶碱在 COPD 急性加重期与稳定期中的治疗地位问题。
稳定期
内科学第 9 版 [2]
中国 COPD 诊治指南(2021 修订版)[1]
茶碱类药物在我国慢阻肺治疗中使用较为广泛。缓释型或控释型茶碱口服 1~2 次/d 可以达到稳定的血浆药物浓度,对治疗稳定期慢阻肺有一定效果。低剂量茶碱在减少急性加重方面尚存在争议。茶碱联合 LABA 对肺功能及呼吸困难症状的改善效果优于单独使用长效 β2 受体激动剂(LABA)。
GOLD 2021[3]
茶碱对稳定期 COPD 有轻微的的支气管扩张作用(A 级证据)并有一些症状改善作用(B 级证据)。
急性发作期
内科学第 9 版:
支气管扩张剂 药物同稳定期(未提及茶碱类)。
中国 COPD 诊治指南(2021 修订版)
茶碱类药物不推荐作为一线的支气管扩张剂,但在 β2 受体激动剂、抗胆碱能药物治疗 12~24 h 后,病情改善不佳时可考虑联合应用,但需要监测和避免不良反应。
GOLD 2021 AECOPD 管理要点:
支气管扩张剂短效 β2 受体激动剂(SABA)或联合短效抗胆碱能药物(SAMA)推荐用于 AECOPD 的治疗(C 级证据);
不推荐茶碱类,因其副作用问题(B 级证据)。
COPD 稳定期药物治疗方案的核心是两张图:
1. 初次诊断的 COPD 应首先进行 GOLD 分组并个体化用药,根据症状水平(mMRC 或 CAT 评分)和过去一年的中/重度急性加重史将患者分为 A、B、C、D 四组,相应的起始药物推荐可参见图 1。
 图 1 COPD 稳定期初始治疗推荐 [3]
图 1 COPD 稳定期初始治疗推荐 [3]
2. 初始治疗后应注意观察患者对治疗的反应,重点评估呼吸困难和急性加重发生情况是否改善,由此调整治疗方案(图 2)。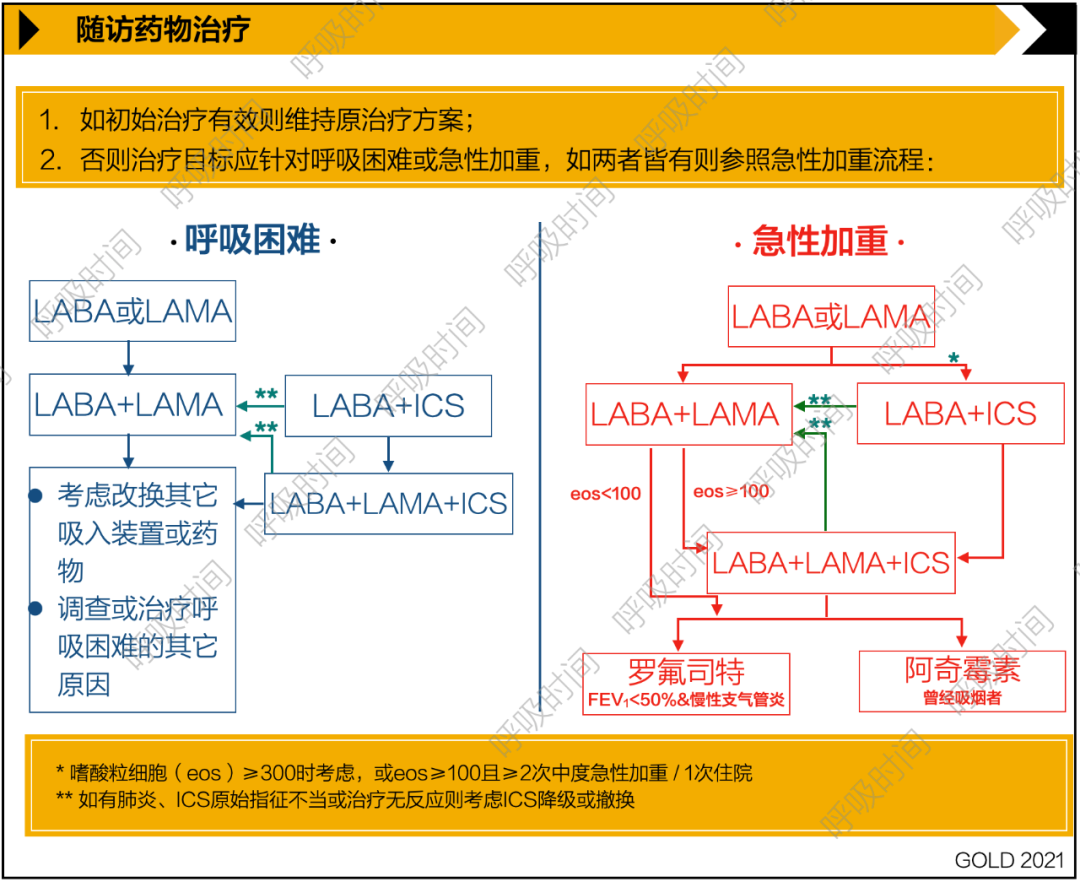 图 2 COPD 稳定期药物治疗的随访流程图 [3]
图 2 COPD 稳定期药物治疗的随访流程图 [3]
可以发现图 1、图 2 中是没有氨茶碱的,一般是在吸入装置无法获得、经济条件较差、基础治疗无效或病人主观不接受等情况下,才考虑使用氨茶碱。
理由与依据
治疗药物的选择最主要考虑有效性与安全性两方面,其次是药物的可获得性、价格、患者的可接受度等。
【有效性】
氨茶碱从 1930 年开始用于临床,因价格便宜,目前仍在发展中国家中广泛应用。但支气管扩张剂中吸入 β2 受体激动剂作用更为强大,吸入激素(ICS)的抗炎作用更为明显 [4]。
研究表明茶碱对稳定期 COPD 与安慰剂相比有轻微的的支气管扩张作用 [5],与单用沙美特罗(属于 LABA)相比,氨茶碱联合沙美特罗可更明显地改善 FEV1 与呼吸困难 [6][7],但是小剂量茶碱减少急性加重的证据却很有限,甚至是矛盾的 [8][9]。
【安全性】
茶碱的治疗剂量与中毒剂量较接近,血液中茶碱浓度 > 5 mg/L 即有治疗作用,> 15 mg/L 时不良反应明显增加。不良反应与个体差异和剂量相关,常见的有恶心、呕吐、腹痛、头痛、胸痛、失眠、兴奋、心动过速、呼吸急促。过量使用可出现心律失常,严重者可引起呼吸、心跳骤停。
药物相互作用:茶碱主要由肝脏细胞色素 P450(CYP)1A2 代谢,同时也由 CYP3A4、CYP2E1 代谢。对这些代谢酶有抑制或诱导作用的药物都可能影响茶碱清除率,导致其血药浓度升高或降低,有可能降低疗效或增加副反应。
所以氨茶碱已经走下神坛,氨茶碱已经不是 COPD 的基础一线治疗用药。
Take Home Message
支气管扩张剂是慢阻肺的基础一线治疗用药;
支扩剂主要有 β2 受体激动剂、抗胆碱能药物及茶碱类药物;
与口服药物相比,吸入制剂的疗效和安全性更优,因此急性加重期支扩剂优先选择 SABA 或联合 SAMA 吸入治疗,稳定期一般优先选择 LAMA 或联合 LABA;
氨茶碱在 COPD 治疗中的地位不高,不推荐作为一线支气管扩张剂。
参考文献:
1. 中华医学会呼吸病学分会慢性阻塞性肺疾病学组; 中国医师协会呼吸医师分会慢性阻塞性肺疾病工作委员会; 慢性阻塞性肺疾病诊治指南 (2021 年修订版). 中华结核和呼吸杂志 2021:170–205.
2. 葛均波, 徐永健, 王辰. 内科学 [M]. 第 9 版. 人民卫生出版社, 2018.
3. Global initiative for chronic obstructive lung disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease(2021 REPORT)[EB/OL]. [2020‐11‐17]. https://goldcopd.org/2021-gold-reports/.
4. Brunton LL, Knollmann BC, Hilal-Dandan R, editors. Goodman & Gilman’s the pharmacological basis of therapeutics., Thirteenth edition. New York: McGraw Hill Medical; 2018.
5. Ram FS, Jones PW, Castro AA, De Brito JA, Atallah AN, Lacasse Y, et al. Oral theophylline for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2002:CD003902. doi: 10.1002/14651858.CD003902.
6. ZuWallack RL, Mahler DA, Reilly D, Church N, Emmett A, Rickard K, et al. Salmeterol plus theophylline combination therapy in the treatment of COPD. Chest 2001;119:1661–70. doi: 10.1378/chest.119.6.1661.
7. Zacarias EC, Castro AA, Cendon S. Effect of theophylline associated with short-acting or long-acting inhaled beta2-agonists in patients with stable chronic obstructive pulmonary disease: a systematic review. J Bras Pneumol 2007;33:152–60. doi: 10.1590/s1806-37132007000200009.
8. Cosío BG, Shafiek H, Iglesias A, Yanez A, Córdova R, Palou A, et al. Oral Low-dose Theophylline on Top of Inhaled Fluticasone-Salmeterol Does Not Reduce Exacerbations in Patients With Severe COPD: A Pilot Clinical Trial. Chest 2016;150:123–30. doi: 10.1016/j.chest.2016.04.011.
9. Zhou Y, Wang X, Zeng X, Qiu R, Xie J, Liu S, et al. Positive benefits of theophylline in a randomized, double-blind, parallel-group, placebo-controlled study of low-dose, slow-release theophylline in the treatment of COPD for 1 year. Respirology 2006;11:603–10. doi: 10.1111/j.1440-1843.2006.00897.x.
