新近一项横断面研究显示,在我国正常人群、糖尿病前期和 2 型糖尿病中,非酒精性脂肪肝(NAFLD)的患病率分别为 23.0% 和 44.0% 和 55.3%。
2 型糖尿病加速 NAFLD 的病情进展,使其逐渐发展成为非酒精性脂肪性肝炎(NASH)、肝纤维化、肝细胞癌等;而 NAFLD 也会反作用于 2 型糖尿病,加重胰岛素抵抗,加重糖脂代谢紊乱,使心血管疾病以及微血管并发症的发生风险增加。
因此,应当重视从非糖尿病 NAFLD 患者中筛查糖代谢异常,从已诊断的糖尿病人群中筛查 NAFLD 并同时评估 NASH 程度和肝病进展。
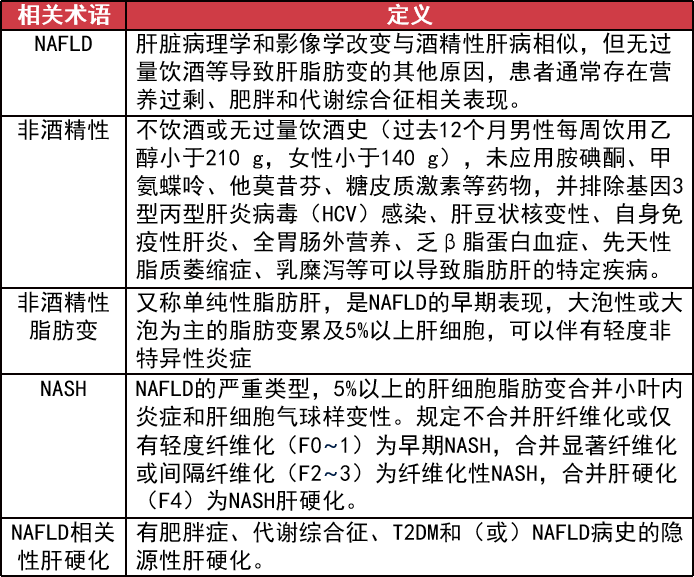
1、NAFLD 相关概念
2、发病机制
近年来,对 T2DM 合并 NAFLD 发病机制的探究可以归纳为以下几个方面:内质网、AMP 激活的蛋白酶、C1q 肿瘤坏死因子相关蛋白(CTRP3)、胰岛素素样生长因子-1(IGF-1)、胎球蛋白 A、成纤维细胞生长因子等原因共同引起。
3、T2DM 合并 NAFLD 应该如何进行筛查
针对筛查,目前美国肝脏病研究学会、韩国糖尿病协会尚不推荐在 2 型糖尿病患者中常规筛查 NALFD;
由于 2 型糖尿病合并 NAFLD 的普遍性以及两者共存潜在的诸多健康风险,欧洲、亚太地区及我国最新的相关指南均建议在 2 型糖尿病患者中开展 NAFLD 的常规筛查以尽早诊断、启始干预、改善预后。
由于肝酶的变化并不一定与肝脏脂肪病变程度一致,因此不推荐使用肝酶筛查 2 型糖尿病中 NAFLD 的患病情况,而肝组织活检虽然是诊断 NAFLD、NASH 肝硬化等疾病的「金标准」但由于其在临床工作中的局限性使其在一般诊断过程中难以普及。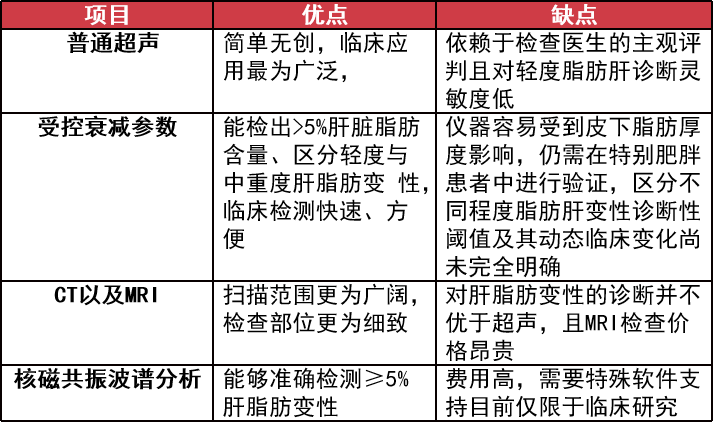
筛查还应包括除外其他有诱因(如 HBV、HCV 等),伴发或伴随疾病严重程度。
4、T2DM 合并 NASH 的临床筛查
(1)非侵入性筛查
非侵入性检查主要以上述的影像学为主。
相关评分系统
NAFLD 纤维化评分(NAFLD fibrosis score,NFS)可通过年龄、 体重指数、是否合并空腹血糖受损或糖尿病、丙氨酸氨基转移酶(ALT)/天冬氨酸氨基转移酶(AST)比值、血小板计数和血白蛋白测值评估 NAFLD 患者肝脏的纤维化程度。当 NFS > 0.676 时有 67% 的 灵敏度和 97% 的特异度提示肝脏已出现进展性纤维化。
FIB-4 指数主要通过年龄、ALT、AST 和血小板计数来评估肝脏进展性纤维化风险,当 FIB4 指数 < 1.45 时大概率排除肝进展性纤维化;当其 >3.25 时倾向考虑出现进展性纤维化。
注:若 2 型糖尿病合并 NAFLD 患者无法通过影像学检查明确肝脏病变程度时,亦可采用 NFS 或 FIB-4 指数进行评估。研究显示 NFS 和 FIB-4 指数对临床肝进展性纤维化的判断准确度不亚于磁共振实时弹性成像。
(2)侵入性检查
侵入性操作主要为肝活检,肝活检是目前评估 NAFLD 病变程度的金标准。国际上对 NAFLD 肝组织病理改变的评估主要有美国的 NAS 评分系统和欧洲 SAF 评分系统。
相关评分系统
NAS 评分系统

注:NAS4 分诊 断 NASH 介于 3 分和 4 分之间考虑 NASH 可能。
SAF 评分系统
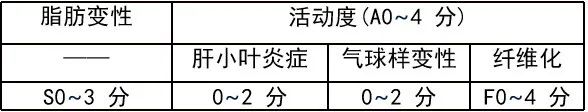
注:NAS 评分多用于临床研究,SAF 多用于脂肪肝严重程度。
若 2 型糖尿病合并 NASH 的患者还合并肥胖症或腹型肥胖、高血压、脂代谢紊乱等代谢综合征包含的其他方面疾病,且长期有饮酒史,属于 NASH 恶变的极高危人群。更易发展为进展性肝硬化和肝细胞癌甚至由 NASH 直接进展为肝细胞癌,故应重视患者开展肝活检时机。
① 我国相关指南建议肝脏瞬时弹性成像检测多次 LSM > 8. 0 kPa 或 NFS > 0.676 应行肝活检;
② 疑似 NASH 患者如 LSM > 13.0 kPa 需监测血清甲胎蛋白必要时 CT 及 MRI 检查排除原发性肝癌。LSM > 15.0 kPa 需高度怀疑肝硬化可能,必要时行胃镜检查排除食管静脉曲张可能,对于这些患者建议消化内科随诊。
(3)生化标志物
血浆细胞角蛋白 18(CK-18)片段与 NASH 有很好的相关性,可以较好地预测 NAFLD 患者中 NASH 患病情况,但目前缺乏商品化的检测,尚未建立诊断阈值。
其他生物标记物如脂联素、瘦素、抵抗素、胃促生长素、成纤维细胞生长因子 21(FGF21)和视黄醇结合蛋白 4,在一定程度上可以反映 NASH 的存在,但尚不能作为诊断指标。
(4)基因分型
在我国中人群中发现,PNPLA3I148 等基因突变与肝脏脂肪沉积具有相关性,但目前基因分型主要用于临床研究。
5、T2DM 合并 NAFLD 的诊断与评估
2 型糖尿病与 NAFLD 的诊断各自满足其诊断标准,且两者同时存在时,可诊断 2 型糖尿病合并 NAFLD。根据新近发布的《中国成人2型糖尿病合并非酒精性脂肪性肝病管理专家共识》推荐,NAFLD 诊断符合以下标准:
(1)病理镜下肝细胞脂肪变性面积 ≥ 5% 的病理学或质子密度脂肪 率 > 5.6% 的影像学改变。
(2)排除肝脂肪变性的继发原因(如病毒性肝炎、自身免疫性肝炎、肝豆状核变性、甲状腺功能减退、性腺功能减退、恶性肿瘤、感染等疾病)之后,可考虑诊断 NAFLD。在作出 NAFLD 诊断之后应进一步评估患者是否存在肝纤维化及其严重程度。
目前全球多个国家对诊断 NAFLD 有着许多分歧,但对比之下,多个国家有一致的诊断意见如下:
(1)NAFLD 的诊断主要依靠病理学和影像学证据;
(1)NAFLD 更倾向于是一种排除性诊断。
其中,2020 年 ADA 糖尿病医学诊疗标准关于 NAFLD 部分的推荐意见:
(1)糖尿病患者通过 FibroScan、肝纤维化生化标志物等技术和指标评估 NAFLD 疾病程度;
(2)糖尿病患者转氨酶升高与增高的体重指数、腰围、TG 水平和低 HDL 水平直接相关;
(3)糖尿病患者 NAFLD 的确诊可能还需要肝活检结果并需要肝病专科医生的参与。需要强调的是:对于 2 型糖尿病合并 NAFLD 的评估不单是肝脏,更要重视两病共存的代谢因素及肝外靶器官的评估。
NAFLD 诊断一旦确定,应该对患者的代谢紊乱状况和心血管风险进行评估:
(1)代谢紊乱的评估
对 NAFLD 患者应该常规测定体重指数、腰围、血压、血糖、血脂谱等以评估 MS 和各个组分。
代谢综合征评估:根据 2005 年国际糖尿病联盟(IDF)提出的代谢综合征定义进行诊断。
糖代谢异常的评估:
① 对无糖尿病病史的 NAFLD 患者应筛查糖尿病及糖代谢异常,进行口服 75 g OGTT 以便糖尿病和糖尿病前期的早期诊断。同步测定胰岛素水平,评估胰岛素抵抗状态;
② 对已经诊断的糖尿病患者应常规进行 NAFLD 筛查与评估。
2 型糖尿病患者脂肪肝/NASH 评估:
NAFLD 患病率在 2 型糖尿病人群中显著升高,而 2 型糖尿病患者更易发展为 NASH 和进展性纤维化。对 2 型糖尿病合并 NAFLD 患者应该同时评估代谢控制状况和无创肝脏病变严重程度。对合并代谢综合征或 NFS 评分 > 0.676 的患者建议行肝活检病理诊断。
(2)是否伴随其他内分泌疾病的评估
多囊卵巢综合征、皮质醇增多症、肾上腺皮质功能减退、甲状腺功能减退、垂体前叶功能减退等。
(3)NAFLD 患者 CVD 风险评估
大量证据表明,NAFLD 与 CVD 风险具有相关性,且独立于其他部位异位脂肪沉积。CVD 是 NAFLD 患者的首要死亡原因。
因此,应对 NAFLD 患者进行心血管相关危险因素进行评估,如 ECG 和(或)颈动脉内中膜厚度(IMT)等测定,有条件可以测定 C 反应蛋白和其他相关的脂肪因子。
可用 Framingham 危险评分评估心血管风险。结合年龄、吸烟史、动脉粥样硬化和心脑血管病变家族史以及代谢综合征各组分情况,对 NAFLD 患者的心血管风险进行全面评估。
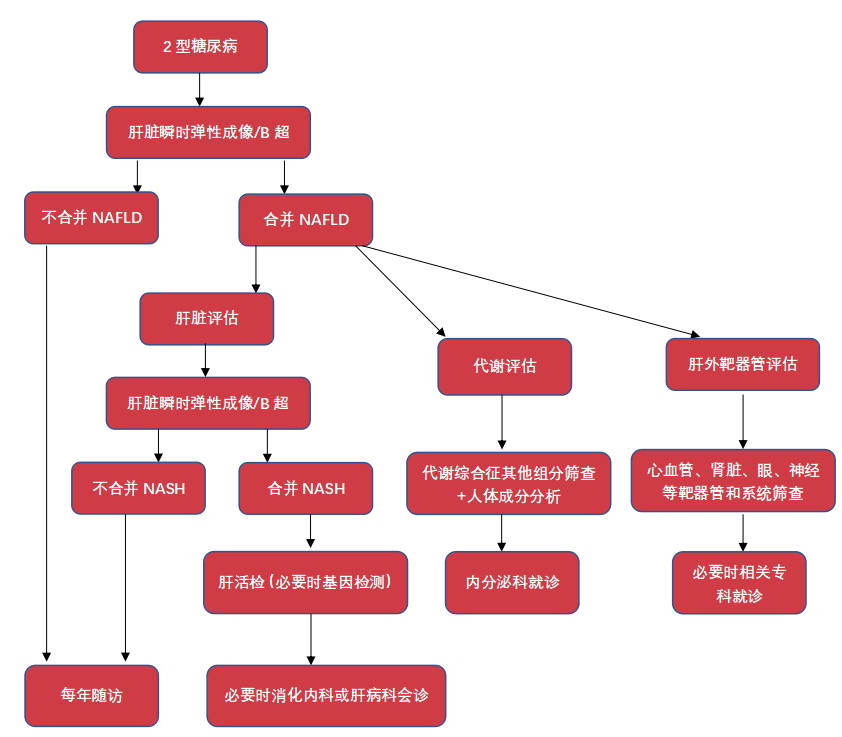 NAFLD 筛查流程图图源:作者结合文献制作
NAFLD 筛查流程图图源:作者结合文献制作
6、T2DM 合并 NAFLD 的管理
包括生活方式干预(饮食、运动、减重等)、药物和手术治疗、心血管风险因素的监测和防治等。
(1)生活方式干预
减少体重和腰围是预防和治疗 NAFLD 及其并发症最为重要的治疗措施。对于超重、肥胖,以及近期体重增加和「隐性肥胖」的 NAFLD 患者,建议通过健康饮食和加强锻炼的生活方式教育纠正不良行为。
饮食:适当控制膳食热量摄入,调整膳食结构,建议适量脂肪和碳水化合物的平衡膳食,限制含糖饮料、糕点和深加工精致食品,增加全谷类食物、ω⁃3 脂肪酸及膳食纤维摄入;一日三餐定时适量,严格控制晚餐的热量和晚餐后进食行为。
运动:避免久坐少动,建议根据患者兴趣并以能够坚持为原则选择体育锻炼方式,以增加骨骼肌质量和防治肌少症。例如:每天坚持中等量有氧运动 30 min,每周 5 次,或每天高强度有氧运动 20 min,每周 3 次,同时做 8 ~ 10 组阻抗训练,每周 2 次。
减重:1 年内减重 3 ~ 5% 可以改善代谢综合征组分和逆转单纯性脂肪肝,体重下降 7 ~ 10% 能显著降低血清氨基酸转移酶水平并改善 NASH,但是体重下降 10% 以上并维持 1 年才能逆转肝纤维化,遗憾的是肥胖症患者 1 年内能够减重 10% 以上者小于 10%。
(2)药物治疗
① 降糖药物
推荐 2 型糖尿病合并 NAFLD 的治疗可依据患者自身的具体情况,考虑优先选择吡格列酮或 GLP-1 受体激动剂,酌情选择 SGLT2 抑制剂、二甲双胍,其他降糖药物不作优选。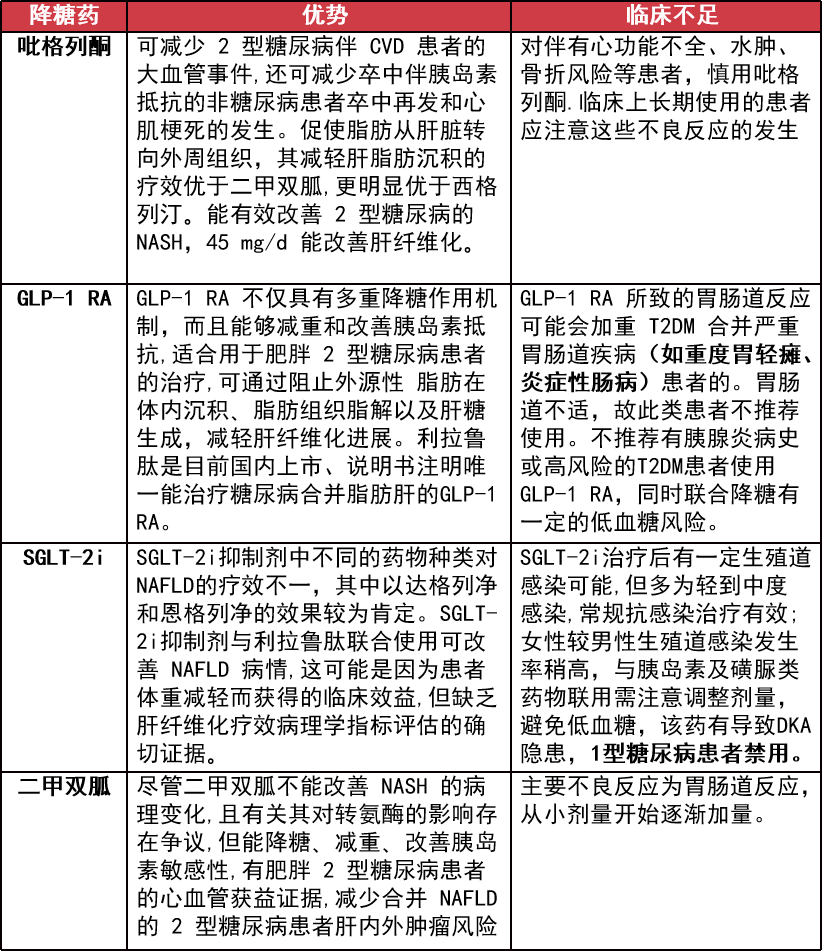
其他药物:DDP-4i 在二甲双胍治疗的基础上,合并使用西格列汀 26 周后可明显减轻肝脂肪沉积,与二甲双胍联用利拉鲁肽治疗组没有明显差异。
② 调脂治疗
临床上常用的贝特类和他汀类药物,都缺乏病理学改善 NASH 和纤维化的较强证据,但两者对于调脂的作用是肯定的。
相较于 2 型糖尿病的血脂控制目标,目前尚无证据提示 2 型糖尿病合并 NAFLD 的血脂控制是否要求更严格,在调脂药物使用过程中,需关注患者血脂、肝功能、甚至肌酶等变化。
③ 降压治疗
ARB 对 NAFLD 的影响证据相对较多,研究证实 ARB 可改善 NASH 的病理改变和血清酶学, 因此 ARB 可安全用于 2 型糖尿病合并 NAFLD 的降压治疗。
④ 其他药物
维生素 E(800 IU/ d)虽然能改善临床脂肪肝的组织学变化,且是国内外多个 NAFLD 指南治疗 NASH 的首选药物,但由于其长期安全性及在 2 型糖尿病患者中使用的证据不确切,故目前不建议其常规用于 2 型糖尿病合并 NAFLD 的治疗。
对于 NASH 患者可考虑联用 1 ~ 2 种护肝药(如多烯磷脂酰胆碱、双环醇、甘草酸制剂、水飞蓟素、S-腺苷蛋氨酸和还原型谷胱甘肽等),连续 3 个月检测肝酶在正常范围后,再巩固治疗 3 ~ 6 个月,可逐渐减量停药。
(3)手术治疗
手术治疗主要包括减重代谢手术及肝移植。
其中减重代谢手术,不仅最大限度地减肥和长期维持理想体重,而且可以有效控制代谢紊乱,甚至逆转 T2DM 和代谢综合征。
国际糖尿病联盟建议,重度肥胖(BMI ≥ 40 kg/m2)的 T2DM 患者,以及中度肥胖(35 kg/m2 ≤ BMI ≤ 39.9 kg/m2)但保守治疗不能有效控制血糖的 T2DM 患者都应考虑减肥手术。
轻度肥胖(BMI 30.0 ~ 34.9 kg/m2)患者如果保守治疗不能有效控制代谢和心血管危险因素也可以考虑减肥手术。
亚裔群体的 BMI 阈值应下调 2.5 kg/m2。
2 型糖尿病可影响肝移植患者围手术期或术后短期的预后,且移植后有较高的心血管并发症风险,肝移植术后仍须有效控制糖脂水平、体重管理等。
✩ 本文仅供医疗卫生等专业人士参考
策划 | 戴冬君
题图 | 站酷海洛
参考文献
1. 2 型糖尿病合并非酒精性脂肪肝的研究近况 2. 中华内分泌代谢杂志 2021 年 7 月第 37 卷第 7 期 中华医学会内分泌学分会. 非酒精性脂肪性肝病与相关代谢紊乱诊疗共识 (第二版)3. 中华内分泌代谢杂志 2019 年 3 月第 35 卷第 3 期 4. 中华全科医师杂志 2021 年 6 月第 20 卷第 6 期
5. 中华内科杂志 2020 年 11 月第 59 卷第 11 期
6. 中国糖尿病杂志 2016 年 10 月第 24 卷第 10 期
7. 现代医学卫生 2018 年 3 月第 34 卷第 5 期
